2019北京高考化学·选择得分技巧
在理综化学高考题目中,最后两道选择题11、12题一般来说难度较高,学生想完全理解,挖掘出每个选项的考点需要耗费大量的时间。但是往往这两道题目的选项中,会出现一些简单的知识点,能够帮助同学们快速解题。下面分两类题目进行总结。
一、电化学类
电化学类选择题通过正正负负、阴阳相吸、阴盛阳衰等口诀,可以做到快速解题。
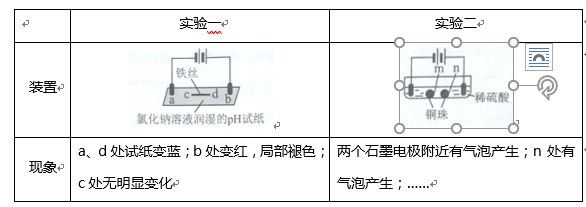
A.a、d处:2H2O+2e﹣═H2↑+2OH﹣
B.b处:2Cl﹣﹣2e﹣═Cl2↑
C.c处发生了反应:Fe﹣2e﹣═Fe2+
D.根据实验一的原理,实验二中m处能析出铜
【提示】现象与方程式直接对应。
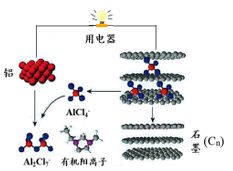
【练习2】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4–和有机阳离子构成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e- + 7AlCl4–=== 4Al2Cl7–
D.充电时的阳极反应为:Cn + AlCl4– – e- === CnAlCl4
【提示】原电池离子“正正负负”,带正电的阳离子移向原电池正极。
【练习3】2016年我国科研人员研制出一种室温“可呼吸”Na?CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是
A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na++3CO2+ 4e—==== 2Na2CO3+C
D.标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
【提示】电解池离子“阴阳相吸”,带正电的阳离子移向电解池阴极。
【练习4】稀硫酸酸化后的软锰矿(主要成分为MnO2)悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4, MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4。下列用来解释事实的方程式不正确的是A.MnO2吸收SO2的反应:MnO2+SO2= MnSO4
B.MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H+=MnOOH
C.MnSO4与KMnO4反应制备MnO2: 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
D.尾气中的SO2还可用足量的氨水吸收:SO2+2NH3·H2O=2NH4++SO32-+H2O
【提示】观察电池环境,确定配电荷的离子。
【练习5】实验室模拟工业制备高纯铁。用惰性电极电解FeSO4溶液制备高纯铁的原理如下图所示。下列说法不正确的是
A. 阴极主要发生反应:Fe2+ + 2e- === Fe
B. 向阳极附近滴加KSCN溶液,溶液变红
C. 电解一段时间后,阴极附近pH减小
D. 电解法制备高纯铁总反应:3Fe2+ === Fe +2Fe3+
电解
D. 电解法制备高纯铁总反应:3Fe2+ === Fe +2Fe3+
【提示】电解池pH变化“阴盛阳衰”,阴极pH升高。
【练习6】研究小组进行如下表所示的原电池实验:
下列关于该实验的叙述中,正确的是
B.实验①中,左侧的铜被腐蚀
C.实验②中,左侧电极的电极反应式为2H++2e-=H2↑
D.实验①和实验②中,均有O2得电子的反应发生
【提示】观察参与电极反应物质。
【练习7】科学家很早就提出锂-空气电池的概念,它直接使用金属锂作电极,从空气中获得O2,和以LiFePO4作电极的锂离子电池相比,增大了电池的能量密度(指标之一是单位质量电池所储存的能量)。右图是某种锂-空气电池的装置示意图,该电池放电时,下列说法不正确的是
A.金属锂为负极
B.若隔膜被腐蚀,不会影响该电池正常使用
C.多孔碳电极上发生的电极反应为:O2 + 2H2O + 4e- == 4OH-
D.锂-空气电池能量密度大的原因之一是转移等量电子时,金属锂比LiFePO4质量小
【提示】科学家的研究成果,每一个组成部分都有独特作用。
【练习8】科学家研制出了一种新型锂—空气电池,其工作原理如图所示。关于该电池的说法中不正确的是
A.回收水性电解液可制取锂
B.可将有机电解液改为水溶液
C.正极的电极反应式为O2 + 4e- + 2H2O = 4OH-
D.电池总反应方程式为4Li + O2 + 2H2O = 4LiOH
【提示】科学家的研究成果,每一个组成部分都有独特作用。
【练习9】下图是一种新型的光化学电源,当光照射光电极时,通入O2和H2S即产生稳定的电流(H2AQ和AQ是两种有机物)。下列说法不正确的是:
A.负极的电极反应为2I--2e-=I2
B.总反应为H2S+O2 H2O2+S
C.H+通过阳离子交换膜从正极区进入负极区
【提示】原电池离子移动“正正负负”,带正电的阳离子移向原电池正极。
【练习10】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验
①
②
③
电压
U1
U2
U3
现象
a极产生少量气泡, b极无明显气泡
a极产生较多气泡,
b极产生少量气泡
a极产生大量气泡,
b极逸出大量黄绿色气体
下列分析不正确的是
A.①、②、③中,a极均发生了还原反应
B.①、②、③中均能发生Cl2+2NaOH=NaCl+NaClO+H2O
C.电解时OH-由b极向a极移动
D.不宜采用实验③的电压制备NaClO
【提示】电解池离子“阴阳相吸”,带负电的阴离子移向电解池负极。
1
2
3
4
5
6
7
8
9
10
B
B
C
B
C
D
B
B
C
C
二、平衡相关
化学平衡类选择题,计算往往相对繁琐,但是掌握简单的读图技巧,熟练运用平衡常数K只与温度有关等知识点,就可以快速解题。
【练习1】钨(W)在高温下可缓慢升华。碘钨灯中封存的碘蒸气能发生反应:W(s)+I2(g) ? WI2(g),利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上。对于该过程的理解不正确的是
A.工作时,电能转化为光能和热能
B.工作时,在灯泡壁和灯丝上发生反应的平衡常数互为倒数
C.W(s)+I2(g) ? WI2(g)为放热反应
D.碘蒸气的作用是延长灯丝的使用寿命
【提示】“温度差”导致K不同。
【练习2】高炉炼铁过程中发生反应:Fe2O3(s)+CO(g)
Fe(s) + CO2(g),该反应在不同温度下的平衡常数见下表。下列说法正确的是
温度T/℃
1000
1150
1300
平衡常数K
4.0
3.7
3.5
A.增加高炉的高度可以有效降低炼铁尾气中CO的含量
B.由表中的数据可判断该反应:反应物的总能量>生成物的总能量
C.为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D.1000℃ 下Fe2O3与CO反应,t min达到平衡时c(CO)=2×10-3 mol/L,则用CO表 示该反应的平均速率为
mol/(L·min)
【提示】K只与温度有关,通过K与T变化可推知反应吸放热。
【练习3】已知:2NO(g) +O2(g) 2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如右图),下列说法不正确的是
A.p1<p2
B.该反应的△H<0
C.A、B两点的平衡常数:K(A)<K(B)
D.A、B两点的化学反应速率:v(A)<v(B)
【提示】K只与温度有关。
【练习4】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是
A.该过程的总反应:
B.该过程中BMO表现较强氧化性
C.降解产物的分子中只含有极性共价键
D.①和②中被降解的苯酚的物质的量之比为3:1
【提示】仔细查看图中循环的物质,一个符号都不能错过。
【练习5】三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g) SiHCl3(g)+H2(g)。同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl) :n(Si)]和反应温度,二者对SiHCl3产率影响如右图所示。下列说法正确的是
A.降低压强有利于提高SiHCl3的产率
B.制备SiHCl3的反应为放热反应
C.温度为450K,平衡常数:K(x)>K(y)>K(z)
D.增加HCl的用量,SiHCl3的产率一定会增加
【提示】读图,观察比例关系对结果的影响。
【练习6】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。下列推论不合理的是
A.活性炭对Cu2+具有一定的吸附作用
B.铁屑和活性炭会在溶液中形成微电池,铁为负极
C.增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D.利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe + Cu2+ = Fe2+ + Cu
【提示】读图,观察比例关系对结果的影响。
【练习7】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.①→②放出能量并形成了C―C键
D.该催化剂可有效提高反应物的平衡转化率
【提示】催化剂只影响速率,不影响平衡。
答案
1
2
3
4
5
6
7
B
B
C
B
D
C
D










