高端疫苗安全性数据 专家带看详细解读
如何理解高端疫苗安全性数据?专家带看详细解读。(图/总统府提供)
高端疫苗10日解盲,99.8%的受试者成功诱发对抗病毒的免疫记忆,然而,这是否代表能顺利预防现正流行的病毒株、能否避免重症,目前均无法回答。针对是否颁布紧急使用授权,卫福部食药署的因应方案是,要求国产疫苗试验结果与国人接种AZ疫苗的结果进行比较、不得逊于AZ疫苗,而官方委托部立桃园医院所做的AZ疫苗接种分析预计6月底出炉,届时就能评估国产疫苗能否如期让民众接种。
高端新冠疫苗二期临床主试验,于今年1月22日开打,4月28日完成4,000多名受试者两剂接种。等待28天抗体生成,由中研院P3实验室检测受试者血清中的野毒中和抗体效价,后续委托第三方临床试验受托机构、美商CRO公司进行数据分析,今日进行期间分析解盲。
2.免疫生成方面,疫苗组接种28天后,血清阳转率(seroconversion rate)达99.8%,中和抗体的几何平均效价(GMT titer)为662,中和抗体倍率比值是安慰剂组的163倍。其中,青壮族群(20~64岁)的反应更佳,血清阳转率为99.9%,中和抗体几何平均效价为733,中和抗体倍率比值为180倍。
「期间分析数据合于预期,本公司将尽快将相关文件送交至食药署进行紧急授权使用审查,并尽速向欧盟、EMA及其他国际药证主管机关咨询及申请第三期临床试验,」李思贤总结。
●该如何理解上述资讯?
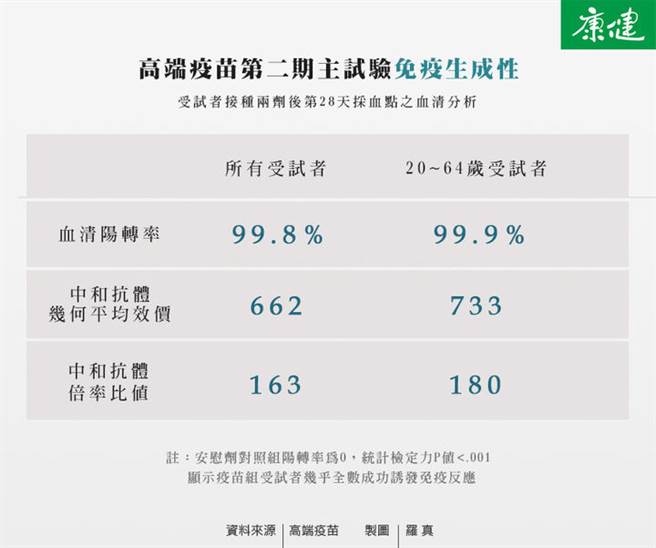
高端疫苗公布第二期主试验的期间分析数据,这项试验还须持续追踪受试者接种后半年的健康状况。图/康健杂志提供)
高端疫苗是一种「次单位重组蛋白」疫苗,也就是取病原体的部分结构、以基因重组技术制成的疫苗,而这款疫苗就是以S-2P抗原搭配铝盐与CpG1018 佐剂制作而成。(注:S-2P抗原平台技转自美国国卫院,S是指新冠病毒棘蛋白部位,2P则为对棘蛋白的两个脯氨酸进行的基因修饰,使抗原结构稳定)
这类疫苗的优点是成分单纯、安全性高,高端公布的报告的确彰显这个特性,除了没有人出现严重不良反应,在常见的轻微不良反应中,疫苗组的发烧率也小于百分之一、只有0.7%,专家学者纷纷表示一如预期。
高端疫苗今日公布第二期主试验的安全性数据。(图/康健杂志提供)
●成功诱发免疫力 但解释资讯不足
在免疫生成性方面,疫苗组的血清阳转率达99.8%(安慰剂组为0),台湾大学公卫学院教授陈秀熙说明,这代表打过疫苗的人当中,有99.8%的人成功诱发对抗病毒的免疫记忆。中和抗体倍率比值163倍,代表接种疫苗的效果比安慰剂组高出许多。
然而,那中和抗体的几何平均效价(GMT titer)数值662,算高或低?
对此,陈秀熙认为参照解释的数据不足。「第一,高端应该将第一期试验及第二期试验的抗体中和浓度进行对照,理论上相同产品,抗体中和浓度应该差异不大。第二,高端应该要进一步拿试验数据跟『确诊者』的血清抗体数据进行比较,但今天未见高端报告」。
高雄医学大学附设中和纪念医院感染内科主任陈彦旭也指出,原则上,中和抗体的几何平均效价的数值越高,代表抵抗「试验病毒株」的能力越好。但要拿高端疫苗跟其他上市疫苗进行比较,必须考虑不同人种、不同的流行病毒株等复杂情形带来的影响,因此很难简单说明这个数值优劣。
●要获紧急授权 6月底将与AZ在台效果比较
由于尚未进行第三期临床试验,高端疫苗目前仍无法明确回答这款产品能带来的保护力,即将于两周后解盲的联亚疫苗亦然,因此,官方要在何种条件下颁布紧急授权使用的命令,近来引发热议。
不过,卫福部食药署也在今日提出折衷的解决方案,上午公布国内新冠疫苗紧急使用授权(EUA)审查标准,其中关于疗效评估,将采免疫桥接(immuno-bridging)方式,也就是衡量国产疫苗诱发产生的免疫原性(中和抗体)结果,是否与国人接种国际上已核准EUA的疫苗相当;如果相当,就能佐证、支持国产疫苗疗效。
卫福部食药署于今年3月下旬就委托部立桃园医院,搜集200名打过AZ疫苗国人的接种数据,相关分析结果预计于6月底出炉。届时,国产疫苗第二期临床试验检体,如果经过相同实验室、相同方法检验所得的中和抗体效价不逊于AZ疫苗,就可获得紧急使用授权,让民众接种。
我国新冠疫苗紧急使用授权审查标准。(图/卫福部食药署提供)
不过,如果在国产疫苗申请紧急使用授权之前,世界卫生组织(WHO)就宣布中和抗体保护力相关指标的阈值数据,那么我国将会参考WHO标准来设定的血清反应率的比较条件。
另外,真实世界中的新冠病毒持续变异,流行的病毒株一直在变化,因此,陈秀熙期待国产疫苗未来能在实验室中进一步进行新旧病毒株的抗体中和浓度比较,以确认疫苗在不同时期能带来的保护力。







