医疗新知》癌症及免疫重症治疗 生物相似性药国际发展趋势
生物相似性药指的是与一个生物制剂相似的药物,能增加治疗可近性。(示意图/Shutterstock)
近年来生物制剂的发展相当迅速,使用范围也愈来愈广泛。义大医院药剂部项怡平部长指出,生物制剂是由活体细胞制作的药物,是大分子药物,能针对特定受体发挥作用,属于较精准的治疗机转,可用来治疗包括乳癌、大肠癌、肺癌、卵巢癌等多种癌症,也运用于多种自体免疫疾病。
所谓的「生物相似性药」指的是与一个生物制剂相似的药物,因为在生物制剂的专利期过后,其他药厂可以根据该生物制剂的胺基酸序列来研发生物相似性药。
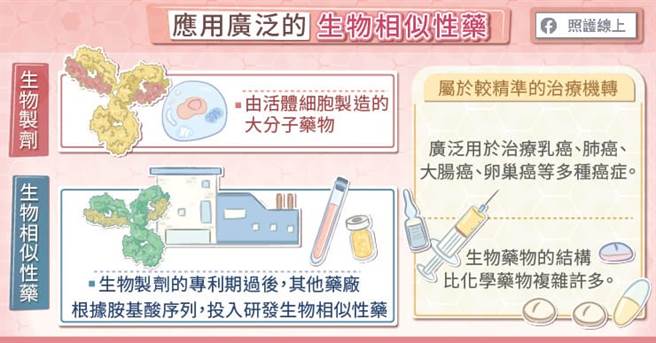
生物相似性药原理。(图/照护线上提供)
由活体细胞制作的生物药物,和由化学反应制作的药物有极大不同,生物药物的分子量大很多、结构也更为复杂。
要制作生物药物,得先将一段特定的DNA序列利用载体植入活体细胞,经过培养后,活体细胞会根据DNA序列制作出胺基酸序列,并进一步组合成四级结构。
项怡平部长说明:「由于制程非常复杂,制作生物药物的门槛很高,不是一般小规模药厂有能力制作的。」
●生物相似性药也需要通过临床试验
生物制剂的机转较为精准,能发挥一定的治疗成效,但是因为研发难度高、制程又复杂,药价往往比较高。而传统化学药物的结构相对较单纯,在找出化学反应的步骤后,其他药厂便能制作出完全相同的化学结构药物,称为学名药。至于大分子的生物药物,在制造过程中会受到很多因素的影响,即使胺基酸序列相同,成品也不尽相同,因此被称为「生物相似性药」。
生物相似性药制程。(图/照护线上提供)
生物相似性药与生物制剂的研发重点不同,项怡平部长分析,「原厂对于生物制剂的制程有自己的独家制程,属于机密,所以其他药厂必须从零开始,自行开发全新标准制程,才有办法做出生物相似性药。而这需要具备制作生物药物经验、较大规模的药厂才有办法进行。」
.第一步-「分析参考药物」为研发生物相似性药的首要步骤,量化各种「关键品质属性(critical quality attribute,CQA)」,包含主结构、立体结构、生物功能、安定性、受体结合与免疫化学特性等。
.第二步-「打造全新标准制程」将DNA序列植入活体细胞,由活体细胞制作胺基酸序列并组合成四级结构,而研发期间需要反复进行比较性测试。
.第三步-「确立生物相似性」,分析各项数据,其相同性愈高,代表生物相似性药与参考药物间临床差异愈小。
.第四步-「进行临床试验」选择高敏感度的受试者族群以及临床指标,评估生物相似性药是否与参考药物之间存在显著的临床差异。生物相似性药须完成临床试验,证明其疗效、安全性皆和参考药物相等,既非劣于、也不优于参考药物,才能申请上市。
●生物相似性药增加治疗可近性,让更多患者受益
项怡平部长解释,「对于一些需要自费使用的病患来说,生物相似性药能够减轻其经济负担。」近几年来已有多种生物制剂被开发出来,专利也陆续到期,相关之生物相似性药也都进入研发阶段,部分生物制剂甚至有多家具规模的药厂投入研发生物相似性药。在愈来愈多样的生物相似性药被开发出来后,不仅能提供给患者更多选择,也有助于降低政府的医疗负担,让有限资源可以得到更充分的利用。目前,世界各国对于生物相似性药都有制定完善的法规,例如美国、日本、澳洲、欧盟、台湾、韩国等,皆已核准通过多种生物相似性药。
生物相似性药增加治疗可近性,让更多患者受益。(图/照护线上提供)
生物相似性药的研发、核准过程皆相当严谨,上市之后政府会持续进行药物监测与定期安全性报告,以确保生物相似性药之品质、疗效、安全性皆与参考药物没有临床差异,保障生物相似性药的品质与安全,以期让患者安心使用。














